بحث عن الاكسدة والاختزال
بحث عن الاكسدة والاختزال
تعد تفاعلات الأكسدة والاختزال من الأسس الجوهرية في الكيمياء، ولها تطبيقات واسعة في مجالات الطاقة، والطب، والبيئة، والصناعة. ومن خلال فهم هذه التفاعلات، نستطيع تطوير حلول أكثر كفاءة في استخدام الطاقة وحماية البيئة. كما أن دراستها تفتح آفاقًا لفهم آليات الحياة والكون من حولنا. وإليك بحث عن الاكسدة والاختزال.
ما هي الأكسدة والاختزال؟
الأكسدة والاختزال (Redox) هما تفاعلان كيميائيان متلازمان يحدثان في العديد من العمليات الكيميائية الحيوية والصناعية. لنفهمهما بشكل مبسط:
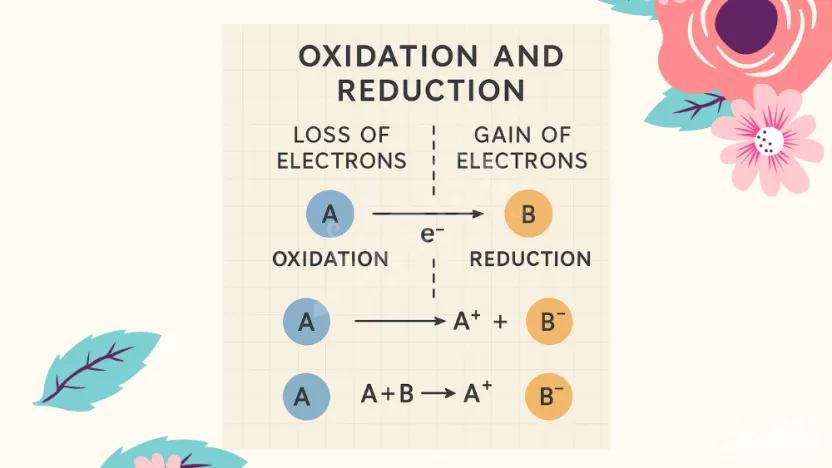
ما هي الأكسدة؟ هي عملية فقدان الإلكترونات من مادة ما.
- مثال: عندما يتحول الحديد إلى صدأ (أكسيد الحديد)، يفقد الحديد إلكترونات ويتحد مع الأكسجين.
- Fe → Fe²⁺ + 2e⁻ (هنا الحديد فقد إلكترونين ← عملية أكسدة)
ما هو الاختزال؟ هو عملية اكتساب الإلكترونات بواسطة مادة ما.
- مثال: عندما يتحول الأكسجين إلى أيون أكسيد، يكتسب إلكترونات.
- O₂ + 4e⁻ → 2O²⁻ (هنا الأكسجين اكتسب إلكترونات ← عملية اختزال)
لماذا يُسميان تفاعلات أكسدة واختزال معًا؟
- لأنهما يحدثان دائمًا معًا: إذا فقدت مادة إلكترونات (أكسدة)، فهناك مادة أخرى لابد أن تكتسبها (اختزال).
بما أن الإلكترونات لا تُفقد أو تُكتسب في الفراغ، فإن كل عملية أكسدة يصاحبها عملية اختزال، ولهذا يسمى التفاعل بالكامل بـ "تفاعل أكسدة واختزال" أو تفاعل Redox أو تفاعل تكاملي.
قاعدة الذاكرة البسيطة:
- OIL RIG
- OIL = Oxidation Is Loss (الأكسدة هي فقدان)
- RIG = Reduction Is Gain (الاختزال هو اكتساب)
أهمية تفاعلات الأكسدة والاختزال
- التنفس الخلوي في الكائنات الحية يعتمد على أكسدة الجلوكوز.
- احتراق الوقود وتوليد الطاقة.
- البطاريات تعمل على مبدأ الأكسدة والاختزال.
- تنقية المعادن واستخراجها من خاماتها.
- معالجة المياه وإزالة الملوثات.
أنواع تفاعلات الأكسدة والاختزال
إليك أهم أنواع تفاعلات الأكسدة والاختزال:
1. تفاعلات الاتحاد (Combination Reactions)
في هذا النوع، تتحد مادتان لتكوين مركب جديد، ويحدث فيه أكسدة لمادة واختزال لأخرى.
- *** مثال: 2H2+O2→2H2O
- الهيدروجين يتأكسد (يفقد إلكترونات)
- الأكسجين يُختزل (يكتسب إلكترونات)
2. تفاعلات التحلل (Decomposition Reactions)
- فيها يتحلل مركب واحد إلى مادتين أو أكثر، وتحدث فيها عملية أكسدة واختزال.
- *** مثال: 2HgO→2Hg+O2
- الزئبق يُختزل
- الأكسجين يتأكسد
3. تفاعلات الإزاحة (Single Displacement Reactions)
يحدث فيها استبدال عنصر نشط بعنصر آخر في مركب، ويكون العنصر النشط هو الذي يتأكسد أو يُختزل.
- *** مثال: Zn+CuSO4→ZnSO4+Cu
- الزنك يتأكسد
- النحاس يُختزل
4. تفاعلات التبادل (Double Displacement Reactions)
- عادة لا تكون تفاعلات أكسدة واختزال إلا إذا كانت تشمل تغييرًا في أعداد التأكسد، مثل التفاعلات بين الأحماض والمواد المؤكسدة.
5. تفاعلات الاحتراق (Combustion Reactions)
تحترق مادة (عادة تحتوي على كربون وهيدروجين) في وجود الأكسجين، منتجة حرارة وثاني أكسيد الكربون والماء. وهي تفاعلات أكسدة واختزال كلاسيكية.
- *** مثال: CH4+2O2→CO2+2H2O
6. التفاعلات الكهروكيميائية (Electrochemical Reactions)
- تشمل تفاعلات تحدث في الخلايا الجلفانية أو التحليل الكهربائي، حيث يتم تحويل الطاقة الكيميائية إلى كهربائية أو العكس.
ملخص سريع:
| النوع | مثال | ما يحدث |
| الاتحاد | H2+O2→H2O | اتحاد عنصرين |
| التحلل | HgO→Hg+O | تفكك مركب |
| الإزاحة | Zn+4CuSO | عنصر يزيح آخر |
| الاحتراق | 4CH+O2 | تفاعل مع الأكسجين ينتج طاقة |
| كهروكيميائية | البطاريات | توليد أو استخدام كهرباء |
معادلات الأكسدة والإختزال
ليك شرحًا مبسطًا مع أمثلة على معادلات الأكسدة والاختزال (Redox Equations)، وكيفية كتابتها وتفصيلها:
مكونات معادلة الأكسدة والاختزال:
- نصف تفاعل الأكسدة: المادة التي تفقد الإلكترونات.
- نصف تفاعل الاختزال: المادة التي تكتسب الإلكترونات.
- المعادلة الكلية: جمع نصفي التفاعل معًا بعد موازنة الإلكترونات.
مثال 1: تفاعل الزنك مع أيون النحاس
Zn+2Cu+→2Zn++Cu
◾ نصف تفاعل الأكسدة (Zn يفقد إلكترونين):
Zn → +2Zn + -2e
◾ نصف تفاعل الاختزال (Cu²⁺ يكتسب إلكترونين):
Cu²⁺ + 2e−→Cu
◾ المعادلة النهائية (بعد موازنة الإلكترونات):
Zn+Cu2+→Zn2++Cu
مثال 2: تفاعل الحديد مع الأكسجين (الصدأ)
4Fe+3O2→2Fe2O3
◾ نصف تفاعل الأكسدة (Fe يتأكسد):
Fe3++3e−→Fe
◾ نصف تفاعل الاختزال (O₂ يختزل):
O2+- 4e−→ -2O2
ثم يتم موازنة الشحنات والذرات لتكوين أكسيد الحديد.
مثال 3: تفاعل الهيدروجين مع الأكسجين
2H2+O2→2H2O
◾ نصف تفاعل الأكسدة (H₂ يفقد إلكترونات):
2H+ + 2e- --> H2
◾ نصف تفاعل الاختزال (O₂ يكتسب إلكترونات):
O2+4e− →2O2−
ثم تتحد الأيونات لتكوين الماء: 2H++O2−→H2O
نصائح لموازنة معادلات الأكسدة والاختزال:
- حدد عدد الإلكترونات المفقودة والمكتسبة.
- وازن الإلكترونات في نصفي التفاعل.
- اجمع النصفيْن واحذف الإلكترونات الزائدة.
- وازن الذرات والشحنات النهائية.
قواعد تحديد الأكسدة والاختزال:
- العنصر الحر له عدد تأكسد = 0.
- الأوكسجين غالبًا عدد تأكسده = -2.
- الهيدروجين غالبًا عدد تأكسده = +1.
- إذا زاد عدد التأكسد ⇒ أكسدة.
- إذا نقص عدد التأكسد ⇒ اختزال.
ما هي قواعد الأكسدة والاختزال؟
إليك قواعد الأكسدة والاختزال التي تُستخدم لتحديد عدد التأكسد (oxidation number) للعناصر والتمييز بين الأكسدة والاختزال في التفاعلات الكيميائية، وتتمثل قواعد الأكسدة والاختزال الأساسية، فيما يلي:
- عدد تأكسد العنصر الحر = صفر، مثل: Na، O₂، Cl₂، Fe → عدد التأكسد = 0
- عدد تأكسد الأيون الأحادي = شحنته، مثل: Na⁺ = +1، Cl⁻ = -1
- مجموع أعداد التأكسد في المركب المتعادل = صفر، مثل: H₂O → (+1 × 2) + (-2) = 0
- مجموع أعداد التأكسد في الأيون متعدد الذرات = شحنته، مثل: SO₄²⁻ → مجموع أعداد التأكسد = -2
- الهيدروجين غالبًا = +1 (إلا في الهيدريدات مثل NaH = -1)
- الأكسجين غالبًا = -2، استثناء في فوق الأكسيد (مثل H₂O₂، يكون = -1)
- الفلور دائمًا = -1 (لأنه أكثر العناصر سالبية كهربائية)
- الفلزات القلوية (المجموعة 1A) = +1 دائمًا
- الفلزات القلوية الأرضية (المجموعة 2A) = +2 دائمًا
كيف نحدد الأكسدة والاختزال؟
- الأكسدة: زيادة عدد التأكسد ⇒ فقدان إلكترونات
- الاختزال: انخفاض عدد التأكسد ⇒ اكتساب إلكترونات
للإستفادة من هذا المقال انسخ الرابط
https://mafahem.com/sl_21223