كيف يمكن فصل الملح عن محلول ماء وملح؟
جدول المحتويات
- كيف يمكن فصل الملح عن محلول ماء وملح؟
- طريقة فصل محلول الملح
- كيف يمكن فصل الملح من محلول الماء والملح عن طريق؟
- في المحلول الملحي(ماء وملح ) ماهو المذيب ؟ الماء الملح الماء والملح لاشي ؟
- يمكن فصل الملح بواسطة .................... في المحلول الملحي. (أ) التكثف (ب) التجمد (جـ) التبخر (د) الانصهار ؟
- فصل الملح عن الماء هي الترشيح؟
- مخلوط من الماء والملح يتم فصله عن طريق الغربال
- كيف يمكن فصل الماء عن الرمل؟
- على ماذا تحصل عند مزج الملح في الماء؟
كيف يمكن فصل الملح عن محلول ماء وملح؟
الإجابة هي: التبخير.
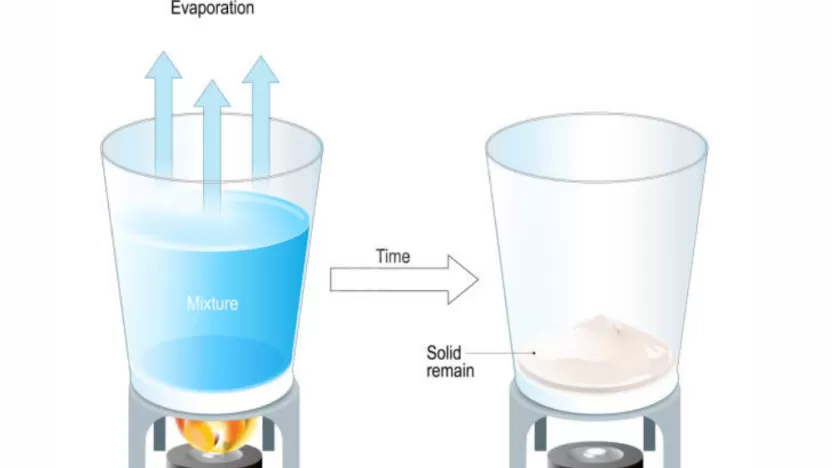
يمكن فصل الملح عن محلول الماء والملح بعدة خطوات علمية واضحة، وأشهرها طريقة التبخير، وفيما يلي التفاصيل:
مبدأ العملية
الطريقة تعتمد على اختلاف درجة الغليان بين الماء والملح:
- الماء مادة متطايرة يتبخر عند التسخين.
- الملح (كلوريد الصوديوم) مادة غير متطايرة، لا يتبخر ويبقى صلبًا.
خطوات التبخير
- يُوضع محلول الماء والملح في إناء مناسب.
- يُسخَّن الإناء تدريجيًا.
- يبدأ الماء في التحول إلى بخار ويغادر الإناء.
- بعد تبخر كل الماء، يتبقى الملح الصلب في قاع الإناء.
لماذا لا يتبخر الملح؟
- لأن درجة انصهاره وغليانه عالية جدًا مقارنة بالماء.
- لذلك يبقى في الحالة الصلبة أثناء تسخين المحلول.
مثال تطبيقي
تُستخدم هذه الطريقة في:
- استخراج ملح الطعام من مياه البحر.
- التجارب المدرسية لفصل المواد الذائبة.
طريقة فصل محلول الملح
لفصل الملح عن محلول الماء، يُمكن اتباع عملية التبخير. يتم ذلك عندما يتبخر الماء من المحلول، مما يترك الملح وحيدًا، يتم ذلك عن طريق:
- تسخين المحلول بحيث يتحول الماء إلى بخار، في حين يبقى الملح في حالته الصلبة.
- بعد التبخير الكامل، يمكن جمع الملح الناتج باستخدام وسائل مناسبة.
- هذه العملية تعتبر وسيلة فعالة للحصول على الملح النقي من المحلول، وتتطلب فقط إجراءات بسيطة ومتاحة.
كيف يمكن فصل الملح من محلول الماء والملح عن طريق؟
الإجابة هي: بالتقطير.
يمكن فصل الملح من محلول الماء والملح عن طريق التقطير، وفيما يلي التوضيح:
مبدأ التقطير
يعتمد التقطير على اختلاف درجات الغليان بين الماء والملح:
- الماء يغلي ويتبخر عند درجة أقل.
- الملح لا يتبخر ويبقى في الوعاء.
خطوات التقطير
- يُسخَّن محلول الماء والملح في دورق.
- يتبخر الماء أولًا.
- يمر بخار الماء عبر أنبوب تبريد (مكثف).
- يتحول البخار إلى ماء نقي يُجمع في وعاء آخر.
- يبقى الملح الصلب في الدورق الأصلي.
ما الذي نحصل عليه؟
- ماء نقي في وعاء الاستقبال.
- ملح صلب متبقٍ في وعاء التسخين.
الفرق بين التقطير والتبخير
- التبخير: الحصول على الملح فقط
- التقطير: الحصول على الماء والملح معًا.
في المحلول الملحي(ماء وملح ) ماهو المذيب ؟ الماء الملح الماء والملح لاشي ؟
الإجابة هي: الماء.
في المحلول الملحي (ماء وملح) يكون المذيب هو الماء.
التوضيح:
- المذيب: المادة التي توجد بكمية أكبر وتقوم بإذابة غيرها (الماء).
- المذاب: المادة التي تذوب في المذيب (الملح).
يمكن فصل الملح بواسطة .................... في المحلول الملحي. (أ) التكثف (ب) التجمد (جـ) التبخر (د) الانصهار ؟
الإجابة هي: (جـ) التبخر.
يمكن فصل الملح في المحلول الملحي عن طريق (جـ) التبخر.
- عند تسخين محلول الماء والملح، يتبخر الماء ويبقى الملح الصلب في القاع.
- التكثف: تحويل البخار إلى سائل.
- التجمد: تحول السائل إلى صلب.
- الانصهار: تحول الصلب إلى سائل.
فصل الملح عن الماء هي الترشيح؟
الإجابة هي: خطأ ❌
الترشيح تستخدم لفصل المواد الصلبة غير الذائبة عن السوائل، مثل فصل الرمل عن الماء، وفي حالة المحلول الملحي (ماء وملح):
- الملح ذائب في الماء، لذلك لا يمكن فصله بالترشيح.
- الطريقة الصحيحة هي التبخير أو التقطير.
مخلوط من الماء والملح يتم فصله عن طريق الغربال
الإجابة هي: خطأ.
الـغربال يُستخدم لفصل المواد الصلبة الكبيرة عن بعضها، مثل الحصى أو الحبوب، وليس لفصل المواد الذائبة.
في حالة المحلول الملحي (ماء وملح):
- الملح ذائب في الماء، لذلك لا يمكن فصله بالغربال.
- الطريقة الصحيحة هي: التبخير أو التقطير.
كيف يمكن فصل الماء عن الرمل؟
الإجابة هي: الترشيح.
يمكن فصل الماء عن الرمل عن طريق الترشيح، لأن الرمل مادة صلبة غير ذائبة في الماء.
- يوضع قمع الترشيح على وعاء مناسب.
- يُوضع ورق ترشيح داخل القمع.
- يُسكب خليط الماء والرمل في القمع.
- يمر الماء عبر ورق الترشيح إلى الوعاء أسفل القمع.
- يبقى الرمل على ورق الترشيح.
على ماذا تحصل عند مزج الملح في الماء؟
الإجابة هي: محلول حامضي أو قاعدي أو متعادل.
الملح (NaCl) يتكون من أيونات: Na⁺ (موجبة)، Cl⁻ (سالبة)
- عند وضع الملح في الماء، تتفكك جزيئاته إلى أيونات حرة → عملية تسمى الإيونيّة أو التفكك الأيوني.
- الماء قطبي، أي له شحنة جزئية موجبة عند الهيدروجين وسالبة عند الأكسجين، فيحيط بالأيونات:
- Na⁺ تحيط بها جزيئات الماء بحيث يكون الأكسجين متجهًا نحوها. Cl⁻ تحيط بها جزيئات الماء بحيث يكون الهيدروجين متجهًا نحوها.
- الناتج: محلول ملحي متعادل، لا حمضي ولا قاعدي تقريبًا.
يمكن ملاحظة الذوبان والتوصيل الكهربائي:
- المحلول يوصل الكهرباء بسبب وجود الأيونات الحرة.
- الماء النقي لا يوصل الكهرباء تقريبًا.
للإستفادة من هذا المقال انسخ الرابط
https://mafahem.com/sl_21905