آخر تحديث: 02/07/2023
كل ما تحتاج إلى معرفته عن خواص الجدول الدوري وتصنيف عناصره
خواص الجدول الدوري؛ هل تساءلت يومًا عن سر الكيمياء والعناصر الكيميائية؟ هل تود معرفة كيف يتم تنظيم العناصر وتصنيفها في الجدول الدوري؟ انطلق معنا في رحلة إلى عالم العناصر الكيميائية، حيث يكمن سر الروابط والصلات الكيميائية. سنكشف لك عن خصائص مجموعات الجدول الدوري والتغيرات التي تحدث بين العناصر. في مفاهيم، هيا اكتشف الأسرار الكيميائية والقوانين الدورية التي تحكم عالمنا المادي.
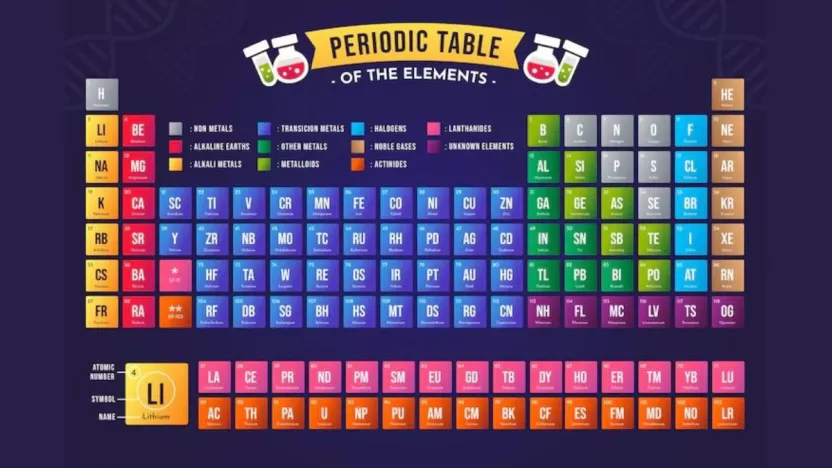

ما هي خواص الجدول الدوري؟
يحتوي الجدول الدوري على ما يقرب من 118 عنصرًا، ويتواجد كل عنصر في موضع محدد في الجدول ويتم تمييزه برمزه الكيميائي. للجدول الدوري العديد من الخصائص المهمة والمميزة، وفيما يلي أهم 7 خصائص:
- تنظيم العناصر: يقوم الجدول الدوري بتنظيم العناصر الكيميائية بشكل منطقي ومنظم بناءً على خصائصها الفيزيائية والكيميائية المشتركة.
- الترتيب الدوري: يتم ترتيب العناصر في الجدول الدوري بحسب تزايد الأعداد الذرية، مما يسمح بالتنبؤ بخواص العناصر المختلفة وعلاقاتها.
- الدورات والمجموعات: ينقسم الجدول الدوري إلى دورات أفقية ومجموعات عمودية. تعكس الدورات ترتيب الإلكترونات في المستوى الفرعي، في حين تشترك العناصر في نفس المجموعة في بعض الخصائص الكيميائية المشتركة.
- الخواص الفيزيائية: يمكن الاستدلال على الخواص الفيزيائية للعناصر من خلال موقعها في الجدول الدوري، مثل نقطة الانصهار والغليان والكثافة.
- الخواص الكيميائية: يوفر الجدول الدوري معلومات حول الخواص الكيميائية للعناصر، مثل قدرتها على التفاعل مع العناصر الأخرى وتشكيل المركبات الكيميائية.
- الاتجاهات الدورية: يمكن ملاحظة الاتجاهات الدورية في الجدول الدوري، مثل زيادة الكهرسلبية أو حجم الذرة، مما يساعد في فهم العلاقات بين العناصر.
- التنبؤ بالعناصر غير المكتشفة: يمكن استخدام الجدول الدوري؛ للتنبؤ بوجود عناصر غير مكتشفة بناءً على الأنماط والاتجاهات الدورية.
تصنيف العناصر في الجدول الدوري
تُصنف العناصر في الجدول الدوري بناءً على خواص الجدول الدوري الكيميائية والفيزيائية المشتركة. وفقًا لتصنيف الجدول الدوري الحالي، يمكن تقسيم العناصر إلى الفئات التالية:
- الفلزات القلوية (Alkali Metals): تشمل العناصر في المجموعة 1، مثل الليثيوم والصوديوم والبوتاسيوم، وتتميز بخواصها القلوية وقابليتها للتفاعل الكيميائي النشط.
- الفلزات القلوية الأرضية (Alkaline Earth Metals): تضم العناصر في المجموعة 2، مثل البيريليوم والمغنيسيوم والكالسيوم، وتمتاز بخواصها القلوية الأقل قوة مقارنة بالفلزات القلوية.
- المجموعة الثالثة إلى المجموعة الثانية عشرة (Transition Metals): تتألف من المجموعة 3 إلى المجموعة 12، وتشمل العناصر مثل الحديد والنحاس والزنك، وتتميز بخواصها الفلزية المتنوعة وقابليتها للتشكيل والتوصيل الحراري والكهربائي.
- المعادن النقية (Post-Transition Metals): تتضمن بعض العناصر في المجموعة 13 إلى المجموعة 16، مثل الألومنيوم والزئبق والأنتيمون، وتتميز بخواصها المعدنية وقابليتها للتشكيل والتوصيل الحراري والكهربائي.
- المجموعة الرئيسية الأخرى (Other Nonmetals): تشمل الهيدروجين والكربون والنيتروجين والأكسجين، وتتميز بخواصها الغير فلزية وقابليتها للتشكيل المختلفة.
- الهالوجينات (Halogens): تمثل العناصر في المجموعة 17، مثل الفلور والكلور والبروم، وتتميز بخواصها النشطة وقابليتها للتفاعل مع الفلزات.
- الغازات النبيلة (Noble Gases): تشمل العناصر في المجموعة 18، مثل الهيليوم والنيون والأرجون، وتتسم بخواصها غير النشطة وعدم قابليتها للتفاعل الكيميائي.
ما هو العنصر الذي له أعلى طاقة تأين؟
- العنصر الذي يمتلك أعلى طاقة تأين (Tyndall energy) هو العنصر رقم 117 في الجدول الدوري، والذي يسمى مؤقتًا بـ "أنون سيبتيوم" (Ununseptium)، ويمثله الرمز Uus.
- تجدر الإشارة إلى أن العناصر ذات الأعداد الذرية الأعلى في الجدول الدوري عادةً تكون غير مستقرة وتتفكك بسرعة، ويكون لديها فترة نصف قصيرة للانحلال الإشعاعي. لذلك، يصعب تحديد الخواص الدقيقة لهذه العناصر حتى يتم تنفيذ المزيد من الأبحاث والتجارب.
عيوب الجدول الدوري
على الرغم من أن الجدول الدوري للعناصر هو أداة قوية ومفيدة في الكيمياء والفيزياء، إلا أنه يواجه بعض العيوب والتحديات، ومن بين العيوب الشائعة للجدول الدوري:
- الفراغات والاستثناءات: يحتوي الجدول الدوري الحالي على بعض الفراغات حيث لم تُكتشف بعض العناصر بعد. بالإضافة إلى ذلك، هناك بعض الاستثناءات لقواعد الجدول الدوري بسبب تفاعلات وخواص خاصة لبعض العناصر.
- عدم تغطية جميع الخصائص: لا يغطي الجدول الدوري جميع الخصائص الكيميائية والفيزيائية للعناصر بشكل شامل. قد تكون هناك خصائص أخرى مهمة للعناصر لم تُدرج في الجدول الدوري الحالي.
- عدم الاهتمام بالترتيب الزمني: لا يعكس الجدول الدوري بالضرورة الترتيب الزمني لاكتشاف العناصر. قد يكون هناك عناصر تم اكتشافها في وقت متأخر وتم وضعها في مكان مناسب في الجدول الدوري.
- العناصر المشتقة والمصطنعة: توجد أيضًا العناصر المشتقة والمصطنعة التي تم إنتاجها في المختبرات، والتي لا توجد في الطبيعة بشكل طبيعي. هذه العناصر غير مشمولة بشكل كامل في الجدول الدوري التقليدي.
- الاعتماد على الخواص الثابتة: يعتمد الجدول الدوري على الخواص الثابتة للعناصر، بينما في الواقع، تتغير بعض الخصائص للعناصر تبعًا للظروف البيئية والظروف التجريبية.
استخدامات الجدول الدوري
تستخدم خواص الجدول الدوري على نطاق واسع في العديد من المجالات العلمية والتطبيقية، بما في ذلك:
- الكيمياء: يعتبر الجدول الدوري أداة أساسية في دراسة وفهم العناصر الكيميائية وخواصها. إنه يساعد الكيميائيين على تحديد التراكيب الإلكترونية والخواص الكيميائية والتفاعلات الكيميائية بين العناصر.
- الفيزياء: يستخدم الجدول الدوري في فهم خواص العناصر الفيزيائية، مثل الكثافة ونقطة الانصهار والغليان والتوصيل الحراري والكهربائي.
- علوم الأرض: يستخدم الجدول الدوري في دراسة التركيب الكيميائي للصخور والمعادن وفهم عمليات الجيولوجيا والتكوين الصخري.
- الصناعة والتكنولوجيا: يستعمل الجدول الدوري في مجالات، مثل صناعة المواد الكيميائية والمواد المحفزة والمواد النانوية والإلكترونيات والطاقة المتجددة.
- الطب: يستعان بالجدول الدوري في فهم تأثير العناصر الكيميائية على الجسم البشري واستخدامها في تطبيقات طبية، مثل العقاقير والعلاجات الكيميائية.
- الزراعة: يساعد الجدول الدوري في فهم تأثير العناصر الكيميائية على نمو النباتات وتطبيقاتها في تحسين الأراضي الزراعية والأسمدة الزراعية.
- البيئة: يستخدم الجدول الدوري في فهم تأثير العناصر الكيميائية على البيئة ودراسة التلوث البيئي وتطبيقات التنمية المستدامة.
في ختام رحلتنا في عالم خواص الجدول الدوري، ندرك أهمية هذه الأداة في فهم العناصر الكيميائية وترتيبها. يمكن للجدول الدوري أن يكشف لنا العلاقات والاتجاهات بين العناصر ويساعدنا على فهم خواصها وسلوكها الكيميائي. إنها أيقونة الكيمياء التي تستمر في إلهام العلماء والباحثين حول العالم.
للإستفادة من هذا المقال انسخ الرابط
https://mafahem.com/sl_20162
تم النسخ
لم يتم النسخ