تنتج الأملاح نتيجة اتحاد الهالوجينات مع الفلزات القلوية

جدول المحتويات
- تنتج الأملاح نتيجة اتحاد الهالوجينات مع الفلزات القلوية؟
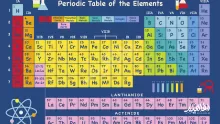
- الفلزات القلوية 2 الهالوجينات 3 عائلة الكربون 4 الغازات النبيلة
- من الغازات النبيلة: الأرجون -النيون ثاني أكسد الكربون - السيلكون الهيدروجين - الأرجون الأكسجين - الهيدروجين؟
- الليثيوم والصوديوم عناصر ضمن عائلة الفلزات القلوية الفلزات القلوية الأرضية الهالوجينات الانتقالية؟
تنتج الأملاح نتيجة اتحاد الهالوجينات مع الفلزات القلوية؟
الإجابة هي: صواب.
عندما تتفاعل الهالوجينات (مثل الكلور، الفلور، البروم، واليود) مع الفلزات القلوية (مثل الصوديوم والبوتاسيوم والليثيوم)، ينتج عن ذلك أملاح، فمثلًا:
- تفاعل الصوديوم (Na) مع الكلور (Cl₂) ينتج كلوريد الصوديوم (NaCl) وهو ملح الطعام.
- التفاعل يتم وفق المعادلة:
2Na+Cl2→2NaCl2Na + Cl₂ → 2NaCl
وهذا النوع من التفاعل يُسمى تفاعل اتحاد مباشر (Direct Combination Reaction).
الفلزات القلوية 2 الهالوجينات 3 عائلة الكربون 4 الغازات النبيلة
1. الفلزات القلوية (Alkali Metals)
- المجموعة: الأولى في الجدول الدوري.
- العناصر: الليثيوم (Li)، الصوديوم (Na)، البوتاسيوم (K)، الروبيديوم (Rb)، السيزيوم (Cs)، الفرانسيوم (Fr).
- الخصائص:
- فلزات لينة يمكن قطعها بالسكين.
- شديدة النشاط الكيميائي، خاصة مع الماء.
- تكوّن أملاحًا عند اتحادها بالهالوجينات.
- تحفظ في الزيت لتجنب تفاعلها مع الهواء.
- مثال على تفاعلها: 2Na+Cl2→2NaCl2Na + Cl_2 → 2NaCl
2. الهالوجينات (Halogens)
- المجموعة: السابعة (17) في الجدول الدوري.
- العناصر: الفلور (F)، الكلور (Cl)، البروم (Br)، اليود (I)، الأستاتين (At).
- الخصائص:
- لا فلزات نشطة جدًا.
- تميل لاكتساب إلكترون واحد لتصبح مستقرة.
- تتحد مع الفلزات لتكوين الأملاح مثل كلوريد الصوديوم.
- أمثلة: الكلور غاز سام يستخدم في التنظيف، واليود مطهر طبي.
3. عائلة الكربون (Carbon Family)
- المجموعة: الرابعة عشرة (14) في الجدول الدوري.
- العناصر: الكربون (C)، السيليكون (Si)، الجرمانيوم (Ge)، القصدير (Sn)، الرصاص (Pb).
- الخصائص:
- تتدرج من لا فلز (الكربون) إلى فلز (الرصاص).
- الكربون أساسي للحياة ويدخل في تركيب جميع المركبات العضوية.
- السيليكون يستخدم في صناعة الشرائح الإلكترونية.
4. الغازات النبيلة (Noble Gases)
- المجموعة: الثامنة عشرة (18) في الجدول الدوري.
- العناصر: الهيليوم (He)، النيون (Ne)، الأرجون (Ar)، الكريبتون (Kr)، الزينون (Xe)، الرادون (Rn).
- الخصائص:
- غير نشطة كيميائيًا (خاملة).
- لا تتفاعل بسهولة مع العناصر الأخرى.
- تستخدم في المصابيح والإضاءة والبالونات.
من الغازات النبيلة: الأرجون -النيون ثاني أكسد الكربون - السيلكون الهيدروجين - الأرجون الأكسجين - الهيدروجين؟
الإجابة هي: الأرجون -النيون.
الغازات النبيلة (Noble Gases): هي عناصر تقع في المجموعة الثامنة عشرة (18) من الجدول الدوري، وتتميز بأنها:
- غير نشطة كيميائيًا (خاملة).
- لا تتفاعل بسهولة مع العناصر الأخرى.
- توجد في الحالة الغازية في الظروف العادية.
أمثلة على الغازات النبيلة: الهيليوم (He) – النيون (Ne) – الأرجون (Ar) – الكريبتون (Kr) – الزينون (Xe) – الرادون (Rn).
- أما ثاني أكسيد الكربون (CO₂) فهو مركب وليس عنصرًا.
- السيلكون (Si) عنصر صلب شبه فلزي.
- الهيدروجين (H) و الأكسجين (O) غازان نشطان كيميائيًا وليسا من الغازات النبيلة.
الليثيوم والصوديوم عناصر ضمن عائلة الفلزات القلوية الفلزات القلوية الأرضية الهالوجينات الانتقالية؟
الإجابة هي: الفلزات القلوية.
الليثيوم (Li) والصوديوم (Na) ينتميان إلى المجموعة الأولى في الجدول الدوري، وتُعرف هذه المجموعة باسم الفلزات القلوية (Alkali Metals).
خصائص الفلزات القلوية:
- شديدة النشاط الكيميائي، خاصة مع الماء.
- تكوّن محاليل قلوية عند تفاعلها مع الماء (ومن هنا جاء اسمها).
- طرية ويمكن قطعها بسهولة بسكين.
- تخزن تحت الزيت لأنها تتفاعل بسرعة مع الهواء والماء.
للإستفادة من هذا المقال انسخ الرابط
https://mafahem.com/sl_21785