آخر تحديث: 04/04/2024
علل جزئ الماء من الجزيئات القطبية
هل الماء قطبي او غير قطبي في حياتنا؟ تشير كلمة القطبية إلى فصل الشحنات الكهربائية، ولعل سواء الماء قطبي أو لا من الأسئلة الشائعة، لذا في هذا المقال في موقع مفاهيم نتعرف معلومات عن قطبية الماء. القطبية الكيميائية مصطلح علمي عيني فصل الشحنات الكهربائية إلى جزئيات، وبهذا الشكل تكتسب المادة عزم ثنائي القطب، أو عزم متعدد القطبية، وهنا نتعرف أكثر على قطبية الماء من عدمها.

ماذا يعني قطبية الماء وغير قطبية؟
قبل أن نجيبكم على سؤال قطبية الماء، من المهم أن نعرفكم أولًا على معنى مصطلحي قطبية وغير قطبية:
أولًا- القطبية
- القطبية هي الروابط التساهمية التي تتكون من ذرات سالبة، ومختلفة، وفيها تسحب الذرة التي بها قيمة سلبية أعلى في معظم الإلكترونات في الرابطة التساهمية.
- وهذا يجعل الذرة تحمل شحنة كهربية سالبة جزئية، أما الذرة الأخرى تحمل شحنة كهربية موجبة جزئية.
- ومثال على ذلك جزيء كلوريد الهيدروجين، فهو يحمل رابطة تساهمية قطبية، حيث تسحب ذرة الكلور التي بها شحنة سالبة كهربية عالية كمية كبيرة من الإلكترونات في الرابطة التساهمية في كلوريد الهيدروجين.
- وهذا يجعل ذرة الكلور تحمل شحنة سالبة، جزئية في حين أن ذرة الهيدروجين تحمل شحنة موجبة جزئية.
- نفهم من ذلك أنه عادة تكن الروابط أو الجزئيات قطبية إذا كانت تحتوي على روابط تساهمية قطبية، ولكن في بعض الحالات لا يحدث ذلك.
ثانيًا- غير القطبية
- في بعض الجزئيات يكون لها شكل هندسي معين، وهذا يعني أن جميع أسطح الجزئيات مكشوفة، ويكون لها قيمة كهربية متساوية، حتى لو كان الجزئي به عدة روابط قطبية.
- ومثال على ذلك جزيئات ثاني أكسيد الكربون، فهي جزيئات غير قطبية على الرغم من أنها تحتوي على رابطتين بين الأكسجين والكربون.
- وفيها تكون جزيئات ثاني أكسيد الكربون غير قطبية؛ وذلك لأنها متماثلة للغاية بين الذرتين، حيث تحتوي كل ذرة على عزم ثنائي القطب، وكل عزم يلغي الآخر ويُبطل مفعوله.
هل الماء قطبي او غير قطبي في حياتنا؟
بعد أن تعرفنا على معنى القطبية وغير القطبية، سنجيب على سؤال هل الماء قطبي أو غير قطبي؟
- الماء جزيء قطبي، وهو أبرز مثال على الرابطة التساهمية القطبية، لأن الإلكترونات في جزيء الماء تتوزع بشكل غير منتظم بين ذرة الأكسجين وذرة الهيدروجين.
- حيث يحمل الأكسجين شحنة سالبة جزئية، ويحمل الهيدروجين جزئيًا شحنة موجبة، وبالتالي تتشكل قطبية الماء نتيجة عدم التوازن في توزيع الرابطة الإلكترونية الهيدروجين مع الأكسجين، وتجدر الإشارة إلى أن الجزيئات القطبية عادة قابلة للذوبان في الماء.
علل جزئ الماء من الجزيئات القطبية
- تسمح الروابط القطبية في جزيء الماء للذرات بالالتصاق ببعضها البعض، حيث يرتبط الجزء السالب بالجزء الموجب مكونًا رابطة هيدروجينية، ويرتبط الهيدروجين، بسبب شحنته الموجبة، بأي ذرة تتميز بقدرة كهربية عالية مثل الأكسجين أو الفلور.
- وهو ما يفسر تقسيم المركب بين المحبة للماء وغير المحبة للماء، لذلك يطلق عليهم اسم المواد القابلة للذوبان في الماء "محبة للماء"، بينما تسمى المواد غير القطبية، غير القابلة للذوبان في الماء، مثل الزيت غير محبة للماء.
هل الماء مركب أيوني؟
المركبات الأيونية هي:
- مركبات قطبية، وهي مركبات تتكون من تفاعل عنصرين، الأول هو معدن يتكون من ذرات تميل إلى فقدان الإلكترونات بسهولة، وهذا يعني أن الماء مركب أيوني.
- بينما تميل العناصر الأخرى غير المعدنية لاكتساب الإلكترونات بسهولة، وبالتالي تنتقل الإلكترونات إلى أيونات.
- يسمح التجاذب الكهروستاتيكي بتحقيق الاستقرار في المركبات الأيونية ويسمى الترابط الأيوني، ومن بين المركبات الأيونية نذكر كلوريد الصوديوم، أو ملح الطعام.
لماذا الماء من المذيبات القطبية؟
يعد سؤال لماذا الماء من المذيبات القطبية من الأسئلة التي تشغل الكثير من الطالب، وإليكم الإجابة:
- عادة لا يختلط المذاب والمذيب مع بعضهما البعض لتكوين محلول واحد متجانس ما لم تكن التفاعلات بين المذاب والمذيب متشابهة أو متماثلة.
- جزيئات المذيب القطبية لها توزيع غير متماثل لكثافة الإلكترون، وتحمل بعض مناطق جزيئات المذيب القطبية شحنة سالبة جزئية، بينما تحمل مناطق أخرى شحنة موجبة جزئية.
- جزيئات المذيب القطبية لها عزم كهربائي ثنائي القطب، ولها تفاعلات كهروستاتيكية قوية مع جزيئات المذيبات القطبية الأخرى.
- سوف تتفكك جزيئات المذيب القطبية وتختلط مع الجزيئات الذائبة فقط إذا كانت عملية الذوبان هذه تخلق تفاعلات مذيب مذاب مشابهة للتفاعلات الكهروستاتيكية بين جزيئات المذيب.
- يعد الماء أحد أبسط المذيبات القطبية، ويحتوي على ذرة أكسجين سالبة كهربية واحدة مرتبطة تساهميًا بذرتين من الهيدروجين.
- حيث تسحب ذرة الأكسجين معظم كثافة الإلكترون الخاصة بها من الرابطة التساهمية بين الذرتين، وينتهي الأمر بأن تكون ذرة الأكسجين غنية نسبيًا بكثافة الإلكترون السالبة، في حين أن ذرتي الهيدروجين تمتلكان كثافة إلكترون منخفضة للغاية.
- يؤدي التوزيع غير المتماثل لكثافة الإلكترون إلى توليد لحظات ثنائية القطب الكهربائي، ويمكن أن يكون لجزيئات الماء تفاعلات كهروستاتيكية قوية مع الجزيئات القطبية الأخرى أو الذرات المشحونة.
- التفاعلات الجزيئية بين جزيئات الماء قوية؛ لأن جزيئات الماء لها عزم كهربائي ثنائي القطب، يمكن أن تشكل المنطقة كثيفة الإلكترون جزيء ماء واحد روابط هيدروجينية قوية مع المنطقة كثيفة الإلكترون جزيء ماء آخر.
- لن تنفصل جزيئات الماء عن بعضها، ولن تنكسر الروابط الهيدروجينية القوية بين جزيئات الماء إلا إذا تمكنت من إنشاء تفاعلات كهروستاتيكية قوية مماثلة مع الجزيئات أو الذرات الذائبة الأخرى.
مثال على ذلك
- عند ذوبان الأملاح الأيونية مثل ملح كلوريد الصوديوم في الماء، تنفصل جزيئات الماء بسهولة، وتتكسر الروابط الهيدروجينية بين جزيئات الماء إذا كان بإمكان الجزيئات تكوين تفاعلات كهروستاتيكية قوية جديدة مع الأيونات المشحونة أو الجزيئات القطبية.
- حيث تتفاعل أيونات الصوديوم الموجبة مع بعض جزئيات الماء السالبة، وتتفاعل أيونات الكلوريد السالبة مع جزئيات الماء الأخرى الموجبة، ولهذا السبب يمكن لأيونات الصوديوم والكلوريد أن يملآن جزيئات الماء المستبدلة.
ما أهمية قطبية الماء؟
كما ذكرنا سابقًا أن معظم المواد القطبية تعمل كمذيبات للأشياء، وهنا تأتي أهمية قطبية الماء، حيث يمكن للماء أن يذوب العديد من المواد المختلفة نظرًا لأنه من المواد القطبية، والسبب أن الماء يحمل أيونات سالبة وموجبة، وهو ما يزيد من قدرته على:
- إذابة العديد من المواد التي تحمل شحنات سالبة وموجبة، حيث تتفاعل الجزيئات الموجبة والسالبة ويتفاعلا معا، وهذا ينتج الذوبان.
- ومثال على أهمية قطبية الماء، أن الملح والسكر مثلًا من المواد الأساسية التي نستخدمها في طعامنا، ويمكنها أن يذوب في الماء بكل سهولة؛ ولولا خاصية الماء التي تعد من المذيبات لما تمكنا من تذوق الكثير من الأطعمة.
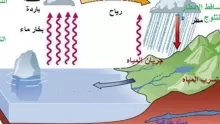
- من الفوائد الأخرى لقطبية الماء أن قطبية الماء يمكنها أن تكون الجليد، حيث يزيد سمك المياه عند التجميد بسبب اختلاف الأيونات داخل نواة ذرة الماء، وهذا ما يجعل الجليد عائمًا على سطح الماء، حيث تكون كثافته أقل من الماء.
يعد سؤال هل الماء قطبي او غير قطبي في حياتنا من الأسئلة المهمة في مادة الكيمياء للطلاب في المدرسة، وفي هذا المقال أجبنا على هذا السؤال، وعرفنا معنى قطبية الماء، وما هي أهمية قطبية الماء، وأشياء أخرى.
للإستفادة من هذا المقال انسخ الرابط
https://mafahem.com/sl_15232
تم النسخ
لم يتم النسخ