ما هي خصائص الأحماض والقواعد في الكيمياء واستخدماتهما؟؟

الأحماض والقواعد في الكيمياء
إن أول من صنف المواد إلى أحماض Acids وقواعد Bases هو العالم الكيميائي روبرت بويل، وكان ذلك في القرن السابع عشر، وتسمى القواعد باسم القلويات، وتمتاز الأحماض والقلويات بالعديد من الخصائص المتعددة وتتمثل في:
- تعريف الأحماض: عبارة عن مواد ذات الطعم الحامضي وتسبب تآكل المعادن وتحول ورقة عباد الشمس إلى اللون الأحمر وأقل حامضية الأحماض عند خلطها مع القواعد.
- تعريف القواعد: بأنها مواد ذات ملمس زلق وتقوم بتحويل ورقة عباد الشمس إلى اللون الأزرق وتقل قاعديه القواعد عند خلطها مع الأحماض.
- قام العالم السويدي سفانت أرهنيوس بتقديم مقترح يوفي بأن الماء قادر على إذابة العديد من المركبات وتفكيكها إلى أيقونات منفردة وذلك في أواخر القرن التاسع عشر.
وتتفكك الأحماض في الماء لإطلاق ايون الهيدروجين وذلك لأنها تحتوي على عنصر الهيدروجين في تركيبها، حيث أنه عند إذابة حمض الهيدروكلوريك (HCl) في الماء يَنتِج أيون الهيدروجين (+H) وأيون الكلوريد (-Cl) تبعا للمعادلة الآتية:
HCl in H2O → H+ (aq) + Cl-(aq)
أما القواعد في عبارة عن مركبات تذوب في الماء وتتفكك إلى أيونات الهيدروكسيد، حيث أنه عند إذابة هيدروكسيد الصوديوم في الماء ينتج عنه أيون الهيدروكسيد (-OH)، وأيون الصوديوم (+Na) تبعا للمعادلة الآتية:
NaOH in H2O → Na+ (aq) + OH(aq)
قاعده لم تستطع نظريه ارهينيوس تفسيرها
ولقد قدم أرهينيوس توضيح الأساسيات الأحماض والقواعد في الكيمياء، حيث أن نظريته وضحت للعديد من الأشياء وهي:
- تتشابه الأحماض والقواعد في العديد من الخصائص وذلك بسبب أن جميع الأحماض تطلق أيون الهيدروجين في المحاليل وأيضا تطلق جميع القواعد أيون الهيدروكسيد في المحاليل.
- عندما تتفاعل الأحماض والقواعد سويا تؤثر بعضها على بعض حيث أن القاعدة تضعف من تأثير الحمض ويضعف الحمض من تأثير القاعدة ويطلق على تلك التفاعلات تفاعلات التعادل.
- وعلى الرغم من ذلك فإن نظرية أرهينيوس لم تستطع تفسير سلوك العديد من المركبات حيث أن بيكربونات الصوديوم تتصرف بشكل يشبه تصرف الأحماض على الرغم من أنه لا يحتوي على أيون الهيدروكسيد.
خصائص الأحماض والقلويات في الكيمياء
لقد كشف العالم روبرت بويل خصائص الأحماض والقواعد عن طريق بعض الاشياء البسيطة للتمييز بين الحموضة والقاعدية وذلك دون الحاجة إلى فعل اختبارات معقدة ومن خصائص الاحماض والقواعد ما يأتي:
- إن مذاق الأحماض حماضي وذلك لان كلمة Acid تعني باللغة اللاتينية حادة أي حامضة، أما مذاق القواعد فإنه مر ولكن لا يجب تذوقهما بأي حال من الأحوال.
- تقوم الأحماض بتغيير لون ورقة عباد الشمس الزرقاء إلى اللون الأحمر أما القواعد فهي لا تغير لون ورقة عباد الشمس ولكنها تقوم بتغيير ورقة عباد الشمس القاعدية الحمراء إلى اللون الأزرق.
- عند تفاعل الأحماض مع معادن نشطة مثل المعادن القلوية والمعادن القلوية الأرضية والألمونيوم والزنك فإنها تطلق غاز الهيدروجين.
- إن ملمس القواعد زلق مثل الصابون ولكن على الرغم من ذلك لا يجب لمسها.
- تشترك الأحماض والقواعد في العديد من الأشياء ومنها أنها إذا تفاعلت بعضها مع بعض فإنها تنتج الماء والأملاح.
- تمتاز محاليل الأحماض والقواعد بأنها قادرة على توصيل التيار الكهربي.
- إن العديد من الأحماض والقواعد القوية قادرة على فعل حروق شديدة إذا تم ملامستها للجلد.
- تسبب الأحماض والقواعد القوية تآكل بعض المواد حيث أنها تميل إلى تكوين الصدأ وتآكل المواد.
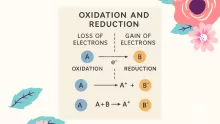
الخصائص التي تشترك فيها الاحماض والقواعد
الأحماض والقواعد هي مواد كيميائية تتميز بخصائص مميزة، ولكنها تشترك أيضًا في بعض الخصائص التي تُميزها عن المواد الأخرى، وفيما يلي أبرز الخصائص المشتركة بين الأحماض والقواعد:
1. التوصيل الكهربائي
كل من الأحماض والقواعد توصل الكهرباء عند إذابتها في الماء، بسبب تكوّن الأيونات.
- الأحماض: تنتج أيونات الهيدروجين.
- القواعد: تنتج أيونات الهيدروكسيد .
2. تأثيرها على الكواشف
كلاهما يُغيّر لون الكواشف الكيميائية (مثل ورقة عباد الشمس):
- الأحماض: تحول لون ورقة عباد الشمس الزرقاء إلى حمراء.
- القواعد: تحول لون ورقة عباد الشمس الحمراء إلى زرقاء.
3. القدرة على التفاعل مع بعض المواد
تفاعل مع المعادن:
- الأحماض تتفاعل مع المعادن النشطة (مثل الزنك والمغنيسيوم) لتكوين غاز الهيدروجين.
- القواعد لا تتفاعل مع المعادن بنفس الطريقة، ولكنها قد تتفاعل مع بعض المعادن مثل الألمنيوم.
التفاعل مع الكربونات:
- الأحماض تتفاعل مع الكربونات لتكوين ثاني أكسيد الكربون.
- القواعد عادة لا تتفاعل مع الكربونات.
4. التأثير الحارق
- كل من الأحماض القوية والقواعد القوية لهما تأثير حارق على الجلد والمواد العضوية، نظرًا لقدرتها على التفاعل مع البروتينات والدهون.
5. التفاعل مع بعضها (التعادل)
- عند خلط الأحماض بالقواعد، يحدث تفاعل تعادل ينتج عنه ماء وملح.
- المعادلة العامة: المعادلة العامة: O
6. الحموضة والقلوية تعتمد على تركيز الأيونات
- الأحماض والقواعد تعتمد على تركيز الأيونات في المحلول:
- الأحماض: تزيد من تركيز في المحلول .
7. القياس بواسطة مقياس الأس الهيدروجيني (pH)
- الأحماض والقواعد يتم تصنيفها بناءً على مقياس الأس الهيدروجيني:
- الأحماض: .
- القواعد: .
الأحماض والقواعد القوية والضعيفة
الأحماض القوية:
- إن الأحماض القوية هي عبارة عن مركبات كيميائية تتأين بشكل كامل في محاليلها المائية حيث أنها تتفكك إلى أيون الهيدروجين وأيون سالب الشحنة، ولكنها مع الأسف إن الأحماض القوية الشائعة محدودة بشكل كبير.
- ومن أمثلة الأحماض القوية حمض الهيدروكلوريك (HCl)، وحمض الهيدرويوديك (HI)، وحمض الهيدروبروميك (HBr)، وحمض النيتريك (HNO3)، وحمض الكبريتيك (H2SO4)، وحمض البيركلوريك (HclO4).
الأحماض الضعيفة:
- إن الأحماض الضعيفة هي التي لا تتأين بشكل كامل في محاليلها، مثل حمض الاستيك حيث أنه لا يتفكك في الماء إلا بنسبة قليلة جدا وتكون هذه النسبة معتمدة على تركيزه في المحلول ويوجد على شكل جزيئات غير منفصلة.
- ومن أمثلة الأحماض الضعيفة حمض الهيدروسيانيك (HCN)، حمض كبريتيد الهيدروجين (H2S)، حمض الميثانويك (HCOOH)، حمض الهيدروفلوريك (HF).
القواعد القوية:
- إن القواعد القوية تتأين بشكل كامل في المحاليل المائية، حيث تنفصل القواعد القوية إلى أيونات بشكل كامل، ويتم تصنيفها على حسب مدى تأينها وهي أيضا عددها محدود جدا.
- ومن أمثلة القواعد القوية هيدروكسيد الليثيوم (LiOH)، وهيدروكسيد الصوديوم (NaOH)، وهيدروكسيد البوتاسيوم (KOH)، وهيدروكسيد السيزيوم (CsOH)، وهيدروكسيد الروبيديوم (RbOH).
القواعد الضعيفة:
- إن القواعد الضعيفة هي مركبات لا تتأين بشكل كامل في المحاليل المائية ومن أمثلة القواعد الضعيفة الأمونيا (NH3)، وميثيل أمين (CH3NH2)، والبَيريدِين (C5H5N).
أمثلة على الأحماض والقواعد في حياتنا واستخداماتها
في حياتنا اليومية، توجد الأحماض والقواعد في العديد من المواد الطبيعية والصناعية التي نستخدمها، وإليك بعض الأمثلة:
استخدامات الأحماض
يتم استخدام الأحماض على نطاق واسع جدا وفي العديد من المجالات ومن تلك الاستخدامات ما يأتي:
- يتم استخدام حمض الاسيتيك في العديد من الاستخدامات المتعلقة بالمنزل حيث يتم تخفيفه ويستخدم كمحلول ويطلق عليه الخل، وأيضا يتم استخدامه في حفظ الأغذية أيضا.
- يتم استخدام حمض الستريك في حفظ الأطعمة حيث أنه جزء أساسي من عصير الليمون وعصير البرتقال.
- يتم استخدام حمض الكبريتيك في صناعة البطاريات بشكل واسع.
- يتم استخدام حمض الكبريتيك وحمض النيتريك في العديد من الصناعات مثل صناعة المتفجرات وصناعة الأصباغ والدهانات وصناعة الأسمدة.
- يتم استخدام حمض الفوسفوريك في صناعة المشروبات الغازية بشكل كبير.
- يتم استخدام حمض الهيدروكلوريك في العديد من الصناعات مثل صناعات الصلب فيتم تنظيف الصفائح المعدنية به قبل القيام بمعالجتها.
استخدامات القواعد
يتم استخدام القواعد بشكل واسع وفي العديد من المجالات ومن تلك الاستخدامات ما يأتي:
- يستخدم هيدروكسيد المغنسيوم كمضاد للحموضة وذلك بسبب أنه يعَل على تقليل الحموضة الزائدة في المعدة وأيضا يستخدم في تليين الأمعاء، ويعرف باسم حليب المغنيسيا.
- يتم استخدام هيدروكسيد الامونيوم في المختبرات حيث أنه من أحد الكواشف الهامة جدا.
- يستخدم هيدروكسيد الصوديوم في العديد من الصناعات حيث أنه يستخدم في صناعة الحرير الصناعي وصناعة الصابون وصناعة الورق أيضا، وأيضا يستخدم في الأغذية حيث أنه يستعمل كعامل كيميائي يساعد على تقشير الفواكه المختلفة.
- يستخدم هيدروكسيد الكالسيوم في صناعة مسحوقات التبييض لذلك يعرف باسم الجير المطفأ، وأيضا يدخل في صناعة الخلطات الجافة للدهان والزخرفة، ويتم استخدامه كملاط بين الطوب في عمليات البناء، وأيضا يعمل على معادلة حموضة التربة.
- يتم استخدام بيكربونات الصوديوم في وصفات صناعة الخبز بشكل أساسي، ويعرف باسم صودا الخبز.
للإستفادة من هذا المقال انسخ الرابط
https://mafahem.com/sl_14697