شرح درس مقدمة في الاحماض والقواعد

جدول المحتويات
مقدمة في الاحماض والقواعد
الأحماض والقواعد مكونات قابلة للذوبان في الماء، إنه تركيز الهيدروجين الذي ينتج أيونات H + عندما تذوب الأحماض في الماء.
من ناحية أخرى، تشير القواعد إلى تركيز الهيدروكسيد، مما يزيد من مكون OH في محلول الماء.
ما هو الحمض وما خصائصه وأنواعه؟
تعطي الأحماض أيونات H + عندما تذوب في محلول مائي، تحتوي الأحماض عادة على ذرات الهيدروجين (H) في مكوناتها.
ومع ذلك هناك استثناءات قليلة لهذا الموقف. المواد المركبة مثل ثاني أكسيد الكربون، وأكسيد النيتروجين، وثاني أكسيد الكبريت يتم حسابها كأحماض على الرغم من أنها لا تحتوي على مكونات الهيدروجين.
في حياتنا اليومية، يوجد أكثر من بنية حمضية في الأطعمة الغذائية، توجد تكوينات حمضية بمكونات مختلفة في الأطعمة أو المشروبات مثل العنب والخل والفراولة والليمون والكولا والتفاح وعصائر الفاكهة والمربيات والمخللات.
عندما ننظر إلى الخصائص العامة للأحماض، نلاحظ أن هناك مكونات يكون طعمها حامضًا بشكل عام، ولها قيمة pH أقل من سبعة، وتنبعث أيونات H + عندما تذوب في الماء.
بالإضافة إلى ذلك، فهو يعكس تركيزًا يقوم بتوصيل التيار الكهربائي في المحاليل المائية، ويتفاعل مع القواعد.
ويتحول إلى ورق عباد الشمس الأزرق ويتحول إلى اللون الأحمر عند إسقاط الميثيل البرتقالي، ولا يتغير اللون عند إسقاط الفينول فثالين، تتحلل الأحماض القوية بشكل عام وتكون كاوية. له تأثير كبير على المعادن والرخام.
هناك أيضًا بعض أنواع الأحماض المستخدمة في الصناعة والصناعة، يستخدم حمض الفوسفوريك لزيادة الكفاءة في تصنيع الأسمدة والأدوية والمواد الحافظة الغذائية والمشروبات الغازية.
يستخدم حامض النيتريك في بعض المتفجرات، وفي إنتاج الديناميت، وفي تشكيل البلاستيك والأسمدة والنيتروجين.
يستخدم حمض الهيدروليك لتنظيف الحمامات والمراحيض، ويستخدم حامض الكبريتيك في صنع المتفجرات والطلاء.
ما هي القواعد وما خصائصها وأنواعها؟
تشير القواعد إلى المواد التي تتبرع بأيونات OH في محلول مائي، يمكن فصل القواعد التي يمكنها توصيل التيار الكهربائي في المحاليل المائية إلى قواعد قوية أو ضعيفة حسب درجة التأين في الماء.
تكون خصائص القواعد بشكل عام على النحو التالي:
- إنها مكونات لها طعم مرير، وتعطي OH- أيونات في المحاليل المائية، ولها قيمة pH أكبر من سبعة، وتجري تيارًا كهربائيًا.
- القواعد التي يمكن أن تتفاعل مع الأحماض، وتعمل على مواد مثل الزجاج والبورسلين، وتشعر بأنها زلقة في المحاليل المائية.
- لوحظ أنه عندما يتفاعل مع مكون الفينولفلاتين، والذي يكون على شكل مسحوق أصفر، فإنه ينتج لونًا ورديًا، بينما يكون أزرق على ورق عباد الشمس الأحمر والأصفر عند إسقاط الميثيل البرتقالي.
قواعد في الصناعة والاستخدام الصناعي ؛ يمكن أن يتحول إلى هيدروكسيد الصوديوم، الذي له هيكل زلق يذوب بسهولة في الماء.
غالبًا ما يستخدم هذا المكون لعناصر مثل الصابون والمنسوجات والطلاء، بينما يستخدم هيدروكسيد البوتاسيوم في منتجات التنظيف، يشارك هيدروكسيد الكالسيوم في تكوين مواد الجير والأسمنت.
بصرف النظر عن هذه، فإن الأمونيا برائحتها عديمة اللون والنفاذة تستخدم بشكل عام في إنتاج الأسمدة والطلاء والأدوية والبلاستيك وحمض النيتريك.
ما هو المطر الحمضي؟
يشير إلى سقوط مكونات كيميائية حمضية في الغلاف الجوي على الأرض على شكل ثلج أو ضباب أو ندى أو مطر.
يمكن تعريفه أيضًا على أنه امتصاص الغيوم بعد التحولات الكيميائية لثاني أكسيد الكبريت ومكونات ثاني أكسيد النيتروجين المنبعثة من الأرض إلى الغلاف الجوي.
هذا النوع من الأمطار، الذي يُرى في البلدان أو المناطق التي تكون فيها الأنشطة الصناعية مكثفة، هو أحد الأسباب الرئيسية لتسمم الأنهار والأضرار التي لحقت بمناطق الغابات ذات الارتفاعات العالية بنوع هطول الأمطار الذي تتركه على الأرض.
هذا الوضع أكثر شيوعًا في البلدان ذات المرافق والأنشطة الصناعية العالية مثل أمريكا والصين وروسيا.
تفاعل الحمض والقاعدة
توجد الأحماض والقواعد أيضًا في الحياة اليومية، على وجه الخصوص، للأحماض أهمية كبيرة لاستمرار الحياة، يوجد حمض الهيدروكلوريك 0.4٪ في عصير المعدة لهضم الطعام.
ما هي أمثلة على التفاعلات الحمضية القاعدية؟
أصغر اللبنات الأساسية للبروتينات هي الأحماض الأمينية، بالإضافة إلى ذلك توجد أحماض في بنية الفواكه والخضروات مثل التفاح والبرتقال والليمون والقراص، المواد مثل الأمونيا والصابون وصودا الخبز معروفة بخصائصها الأساسية.
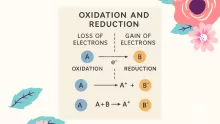
تتشكل الأملاح عندما تتفاعل الأحماض والقواعد، من المعروف أن الأملاح مركب مهم. في هذه التفاعلات، لوحظ أيضًا تكوين الماء بالإضافة إلى الملح، تُعرف ردود الفعل هذه أيضًا باسم تفاعلات التحييد.
تحدث تفاعلات التعادل في المحاليل المائية للأحماض والقواعد؛ لهذا السبب يتم فصل المحاليل الملحية المتكونة في التفاعل إلى أيونات، تفاعلات الحمض القاعدي
يحدث على شكل حمض + قاعدة> ملح + ماء.
من المهم جدًا معرفة صيغ الأحماض والقواعد من أجل كتابة معادلات التفاعلات الحمضية القاعدية.
فيما يلي أسماء وصيغ بعض الأحماض:
- حمض الهيدروكلوريك حمض الهيدروكلوريك.
- حمض الهيدروبروميك HBr
- حمض الهيدرويوديك HI
- حامض الكبريتيك H2SO4
- حمض النيتريك HNO3
- حمض الفوسفوريك H3PO4
أسماء بعض القواعد والصيغ هي كما يلي:
- هيدروكسيد الصوديوم NaOH
- هيدروكسيد البوتاسيوم KOH
- هيدروكسيد الكالسيوم Ca (OH) 2
- هيدروكسيد المغنيسيوم Mg (OH) 2
- الأمونيا NH3
- هيدروكسيد الباريوم Ba (OH) 2
معادلة تفاعل HCl و NaOH:
حمض الهيدروكلوريك (في الماء) + هيدروكسيد الصوديوم (في الماء) > كلوريد الصوديوم (في الماء) + H2o (s)
تتفاعل المحاليل المائية لحمض HCl وقاعدة NaOH لتكوين الماء والملح، يسمى تكوين جزيئات الماء عن طريق تفاعل أيونات الهيدروجين للأحماض وأيونات الهيدروكسيد من القواعد بالتعادل.
أثناء تفاعلات التعادل، يتحد مول واحد من أيونات H و1 مول من أيونات OH، لهذا السبب، من الضروري النظر إلى معدل الاقتران، والذي يكون بهذه الطريقة أثناء موازنة التفاعل.
في هذه التفاعلات، يجب كتابة المعاملات ذات الصلة في صيغ المركبات. في تفاعلات التعادل، يجب أن تكون قيمة الأس الهيدروجيني 7.
للإستفادة من هذا المقال انسخ الرابط
https://mafahem.com/sl_11327