أمثلة على قانون حفظ المادة
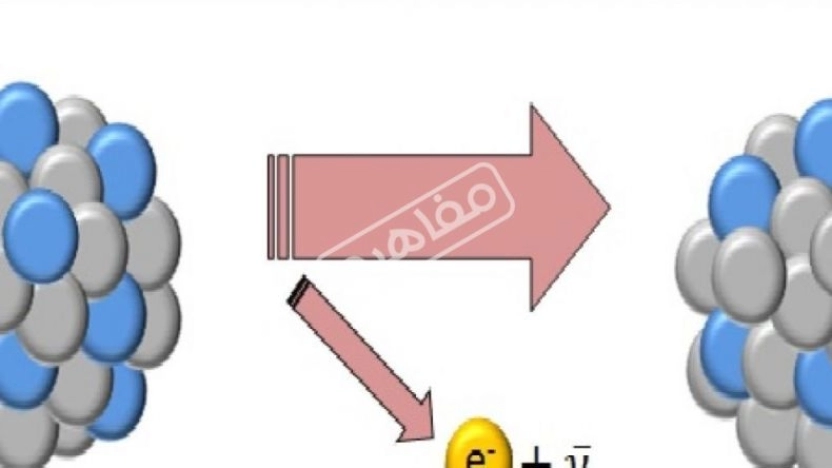
تعريف قانون حفظ الماده
قانون بقاء المادة هو مفهوم أساسي في الكيمياء والفيزياء ينص على أن المادة لا تُخلق ولا تُفنى، بل تتحول من شكل إلى آخر خلال التفاعلات الكيميائية والفيزيائية. يُعرف هذا القانون أيضًا باسم قانون حفظ المادة.
نص القانون:"المادة لا تُخلق ولا تُفنى؛ بل تتحول من شكل إلى آخر."
- يشير مفهوم قانون الحفاظ على المادة إلى أن وجود المادة في نظام مغلق أو منعزل معين يعني أنه لا يمكن إضافة المزيد من الكتلة أو تقليلها، ولا يمكن أن يتغير من شكل إلى آخر إلا بالحفاظ على ثبات كتلته.
- قانون الحفاظ على الكتلة صحيح أيضًا لأنه لا يتم تحويل جميع العناصر الموجودة على سطح الأرض إلى عناصر أخرى أثناء التفاعلات الكيميائية.
- على سبيل المثال، تم تغيير ذرة الكربون المدفونة منذ أكثر من 65 مليون سنة، في شكل فحم، إلى العديد من العناصر، لكنها بقيت كما هي ولم تتحول إلى عناصر أخرى، وتحدث تفاعلات الاندماج حيث يتم إنتاج عناصر جديدة.
قانون حفظ المادة في الفيزياء
- قد يبدو مفهوم قوانين حفظ المادة كمجموعة من القوانين المصممة لحماية البيئة، ولكن في الفيزياء يشير إلى عدة مبادئ خاصة بجوانب معينة من الكون المادي لا تتأثر بالتفاعلات المختلفة.
- بمعنى أنه يتم الحفاظ على الطاقة، بما في ذلك الزخم الزاوي والزخم الخطي وخصائص الكتلة ومع ذلك، يمكن الحفاظ على الكتلة في عدد من الحالات.
- ويتم توضيح مبدأ الحفاظ على المادة في الممارسة العملية من خلال بعض الأمثلة الشائعة، مثل إسقاط الكرة كمثال للحفاظ على الطاقة، وتحريك لوح التزلج كمثال على الحفاظ على زاوية حادة، الارتداد في مسدس بعد إطلاق قذيفة كمثال على الحفاظ على الزخم الخطي.
- يعد ركوب الدراجات مثالاً على توفير الزخم الزاوي من الحياة العملية، حيث تدور العجلات الدوارة وفقًا لسرعة الركوب، كما أن الحفاظ على العجلات في حالة حركة سيجعل من السهل الحفاظ على دورها ويجعل من الصعب تغيير مقدار الزخم الزاوي.
قانون حفظ المادة في الكيمياء
يعني أن كتلة المواد المتضمنة في تفاعل كيميائي تساوي كتلة المواد الناتجة إذا حدث هذا التفاعل في نظام معزول، باستثناء أنه أثناء التفاعل، تكون الكتلة الإجمالية للمنتجات مساوية للكتلة الإجمالية للمواد المتفاعلة.
- ساعد هذا العلماء على فهم حقيقة التفاعل الكيميائي، لأنه لا يخفي المواد المتفاعلة كما تظهر على السطح، بل يحولها إلى مواد أخرى ذات كتلة متساوية.
- أنطوان لافوازييه الكيميائي ومكتشف هذا القانون يقول "الذرات من مادة لا يمكن تكوينها أو تدميرها، ولكن يمكن نقلها وتقسيمها إلى جزيئات مختلفة ويمكن تحويلها".
- في الأحداث الكيميائية، يكون مجموع كتل المواد المتفاعلة مساويًا لمجموع كتل المواد المتكونة في نهاية التفاعل، والقانون ينص على أن الكتلة ستبقى ثابتة بغض النظر عن الدورات والعمليات الموجودة في نظام مغلق.
- بالمصطلحات المكافئة، يمكن إعادة ترتيب حالة الكتلة، لكن لا يمكن إنشاء الكتلة أو تدميرها وبالتالي، في أي تفاعل كيميائي وعملية داخل نظام مغلق، يجب أن تكون كتلة المواد المتفاعلة مساوية لكتلة المنتجات.
- لا يتم تحويل الكتلة إلى طاقة في التفاعلات الكيميائية، لكن في التفاعلات النووية، يمكن تحويل الكتلة إلى طاقة وفقًا لـ E = mc². [3].
- يمكن شرح القانون الأساسي في أن كمية المادة في كل معاملة هي نفسها قبل العملية وبعدها، ونوعية المواد الأساسية هي نفسها، ولا يوجد سوى التحولات والأشكال المتغيرة وأصبحت هذه المعرفة أساس الكيمياء والكمية الحديثة وأصبحت فيما بعد تعرف باسم "قانون حفظ الكتلة" في التفاعلات الكيميائية.
يطبق قانون حفظ الكتلة على المواد المتفاعلة فقط
قانون حفظ الكتلة ينص على أن الكتلة تُحفظ في جميع التفاعلات الكيميائية، سواء كانت المواد المتفاعلة أو المنتجات. بمعنى آخر، الكتلة الكلية للنظام تظل ثابتة قبل وبعد التفاعل. هذا يعني أن الكتلة لا تُفنى أو تُخلق من العدم، ولكن تُعاد توزيعها.
في المواد المتفاعلة:
- الكتلة الكلية للمواد المتفاعلة في التفاعل تكون مساوية للكتلة الكلية للمواد الناتجة. إذا كان لديك 100 جرام من المواد المتفاعلة، فإن الكتلة الكلية للمواد الناتجة ستكون أيضًا 100 جرام.
في المواد الناتجة:
- المنتجات التي تُنتج عن التفاعل الكيميائي تكون بمجموع كتلة المواد المتفاعلة. على سبيل المثال، إذا تفاعل 50 جرام من مادة A مع 30 جرام من مادة B، فإن الكتلة الكلية للمواد الناتجة ستكون 80 جرام.
مثال، في تفاعل احتراق، مثل حرق الهيدروجين في الأكسجين لتكوين الماء، إذا بدأت بكتلة معينة من الهيدروجين والأكسجين، فإن الكتلة الكلية للماء الناتج ستكون مساوية للكتلة الكلية للهيدروجين والأكسجين المستخدمين.
H2+O2→2 H2O2
أمثلة على قانون حفظ المادة
الطاقة الشمسية هي أحد الأمثلة العملية للقانون، حيث تتحول الطاقة من شكل إلى آخر في سلسلة كبيرة من التغيرات الفيزيائية والكيميائية في الأنظمة الحية، وذلك يرجع إلى الآتي:
- الطاقة الشمسية يتم تحويلها إلى طاقة كيميائية ثم إلى طاقة ميكانيكية، وفي كل مرحلة من هذه المراحل عالية الجودة تتحلل الطاقة وتتدفق إلى الوسط الجديد لتصبح منخفضة الجودة ولا يمكن الحصول على المزيد من الطاقة وفقًا للقانون.
- من خلال التغييرات الفيزيائية أو الكيميائية التي تصاحب عملية تحويل الطاقة، فإن طاقة الإدخال تساوي دائمًا طاقة الخرج.
مثال آخر، هو السخان الكهربائي:
- فعند التشغيل، يتم تحويل الطاقة الكهربائية إلى طاقة حرارية، وعند قياس كمية الكهرباء التي تدخل السخان، فإنها ستكون مماثلة للحرارة التي تولدها.
- أي الطاقة التي يتم توفيرها أثناء عملية التحويل التي يحدث في نظام مغلق وهو السخان.
مثال آخر، عند تسخين 10.0 جم من كربونات الكالسيوم (CaCO3)، يتم إنتاج 4.4 جم من ثاني أكسيد الكربون (CO2) و5.6 جم من أكسيد الكالسيوم (CaO).
- المحلول: كتلة المواد المتفاعلة = كتلة المنتجات 10.0 جم
- كربونات الكالسيوم = 4.4 جم من ثاني أكسيد الكربون + 5.6 جم
- أكسيد الكالسيوم 10.0 جرام في المواد المتفاعلة = 10.0 جرام في المنتجات
- نظرًا لأن كتلة المواد المتفاعلة تساوي كتلة المنتجات، فإن هذا التفاعل يطبق قانون حفظ الكتلة أو المادة.
مثال آخر: بتسخين مركب HgO ينقسم إلى مكونات Hg و1 / 2O2 لذلك، فإن المادة التي يتلقاها في البداية يتم صقلها فقط في مكوناتها، ونظرًا لأن غاز O2 الناتج لا يمكن أن يذهب إلى أي مكان سوى الفضاء، ويتم حفظ الكتلة في الأحداث الكيميائية.
- وفقًا للنظرية السائدة، فإن الاحتراق يعني أن الجسم المحترق يقذف مادة غامضة تسمى "phlogiston"، لكنها غير معروفة ما هي.
- توصل لافوازييه إلى الاستنتاج التالي في التجربة،أنه إذا كان الوزن المفقود بتحويل أكسيد الزئبق إلى زئبق تحت الحرارة مساوياً لوزن الغاز المنطلق، فهذا يعني أن الاحتراق لا يحدث عن طريق إطلاق الجسم المحترق عن مادة فلوجستون، ولكن بدمجه مع الجزء الفعال من الهواء (أي الأكسجين).
- الميزة الأخرى التي جعلت لافوازييه لا يُنسى هي حساسيته غير العادية في قياس التغيرات الكيميائية للأجسام، حيث تتيح له هذه الميزة تقديم مبدأ علمي مهم جدًا يُعرف باسم "قانون الحفاظ على الكتلة".
أهمية قانون حفظ المادة
يعتبر قانون حفظ المادة مهمًا لأن له عدة استخدامات وفوائد، ومنها:
- دراسة وإنتاج التفاعلات الكيميائية، فعندما يكون نوع وكمية المواد المتفاعلة معروفاً، يمكن تقدير كمية المواد المنتجة.
- يمكن لمصنعي الكيمياء زيادة كفاءة الإنتاج من خلال تطبيق قانون الحفاظ على الكتلة.
- اكتشاف القانون ساعد على احترام علم الكيمياء، وهو بعيد كل البعد عن السحر والوهم بين العلوم.
نتج قانون حفظ المادة عن تجارب العالم
على الرغم من أن قانون الحفاظ على الكتلة قد تم تقديمه لأول مرة من قبل نصر الدين توسو في القرن الثالث عشر، وكانت هناك أوجه قصور في هذه النسخة الأولى، وقد كتب أن بنية المادة يمكن أن تتغير لكنها لا تختفي.
- حقق لافوازييه أول تعريف واضح لقانون الحفاظ على الكتلة في عام 1789. في الواقع، لهذا السبب، يُقال أحيانًا إنه والد الكيمياء الحديثة.
- ومع ذلك، فقد توصل ميخائيل لومونوسوف بالفعل إلى أفكار مماثلة في عام 1748 وأثبتها من خلال تجارب مختلفة.
- لم يقتصر أسلاف أعمال لافوازييه على هذا، وقد تم تقديم أفكار مماثلة في وقت سابق من قبل جوزيف بلاك، وهنري كافنديش، وجان ري.
- أثبت أنطوان لوران لافوازييه (1743-1794) أن أكاسيد المعادن عبارة عن مركبات يعطى من الأكسجين والمعادن اكتشفها سابقًا جوزيف بريستلي (1733-1804) وكارل فيلهلم شيل (1742-1786)، مما يعطي تفسيرًا صحيحًا لظاهرة الاحتراق والأكسدة حتى اليوم.
- لقد قاموا بعمل قيم للغاية في التسميات الكيميائية، حيث تم وضع تعريف كمي للعنصر من خلال إعطائه معناه الحقيقي في تجارب الحاويات المغلقة.
- تبين أن الكتلة لم تتغير أثناء التفاعلات الكيميائية وتم تقديم القانون على هذا الأساس، وتم وضع الأساليب الكمية في الكيمياء.
- أدى كتاب لافوازييه "السمات Élémentaire de Chimie" (دراسة في الكيمياء الأساسية) الذي نُشر عام 1789 إلى ثورة في الكيمياء، تعادل مبادئ نيوتن في الفيزياء.
للإستفادة من هذا المقال انسخ الرابط
https://mafahem.com/sl_11347