حامض الكبريتيك يستخدم لصهر النحاس وإذابتة
جدول المحتويات
- حامض الكبريتيك يستخدم لصهر النحاس وإذابتة صح أم خطأ ؟
- كيف يمكن صهر النحاس؟
- تفاعلات النحاس مع الأحماض
- ما هو الدافع الذي يجعل النحاس يتفاعل مع حمض الكبريتيك؟
- ما هو حامض الكبريتيك؟
- لماذا يستخدم حمض الكبريتيك في تعدين النحاس؟
- دور حمض الكبريتيك في التفاعل
- ما الذي لا يتفاعل مع حمض الكبريتيك؟
- فوائد وأضرار حمض الكبريتيك
- احتياطات السلامة عند استخدام حامض الكبريتيك
حامض الكبريتيك يستخدم لصهر النحاس وإذابتة صح أم خطأ ؟
الإجابة: خطأ ❌
حمض الكبريتيك لا يُستخدم لصهر النحاس، بل يُستخدم في عمليات كيميائية مثل:
- إذابة أكاسيد النحاس في الخامات.
- تنقية النحاس كهربائيًا بعد إذابته.
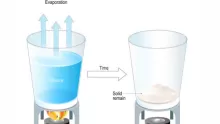
أما الصهر (التحويل من صلب إلى سائل)، فيتم باستخدام حرارة عالية (حوالي 1085 درجة مئوية) وليس باستخدام حمض.
- الصهر (Melting): هو تحويل النحاس من الحالة الصلبة إلى السائلة، ويتم ذلك عبر تسخينه إلى درجة حرارة 1085°C، وهي درجة انصهاره.
- الاستخلاص الكيميائي أو التنقية: في بعض العمليات مثل الترشيح الحمضي (leaching)، يُستخدم حمض الكبريتيك المخفف لإذابة أكاسيد النحاس من الخامات، ثم يُستخلص النحاس كهربائيًا أو كيميائيًا.
كيف يمكن صهر النحاس؟
صهر النحاس هو عملية تحويل النحاس من حالة صلبة إلى سائلة باستخدام الحرارة العالية. يتم ذلك عادة في أفران صهر مخصصة، وتتم العملية وفقًا للخطوات التالية:
1. التحضير الأولي:
- يتم تحضير الخام (مثل خام الكبريتيد) الذي يحتوي على نحاس خام، أو يتم استخدام نحاس معاد تدويره.
2. التسخين في فرن الصهر:
- يتم تسخين النحاس إلى درجة حرارة تتراوح بين 1000-1200 درجة مئوية (درجة انصهار النحاس 1085 درجة مئوية) (أي ما يعادل حوالي 1984.32 درجة فهرنهايت)، ويتحول النحاس من الحالة الصلبة إلى السائلة، حيث يظل في حالته السائلة حتى درجة حرارة غليانه (حوالي 2562 درجة مئوية).
- يتم ذلك باستخدام فرن صهر كهربائي أو فرن غازي، أو في بعض الحالات فرن عالي الحرارة.
3. إزالة الشوائب:
- مع الوصول إلى درجة الحرارة المطلوبة، تذوب الشوائب مثل الكبريت والأكاسيد، وتفصل عن النحاس المنصهر.
- يتم إضافة مواد مضافة (مثل الجير أو الكربونات) لالتقاط الشوائب وتكوين خَبَث (slag) الذي يمكن التخلص منه.
4. الصب والتشكيل:
- يتم صَب النحاس المنصهر في قوالب للحصول على أشكال مختلفة من النحاس.
- النحاس يمكن أن يُشكل إلى أسلاك أو ألواح حسب الحاجة.
الهدف من صهر النحاس:
- تحسين نقاوة النحاس.
- إزالة الشوائب التي تقلل من جودة النحاس.
- إنتاج النحاس في أشكال قابلة للاستخدام في صناعة الأسلاك والأدوات.
تفاعلات النحاس مع الأحماض
النحاس لا يتفاعل مع الأحماض الضعيفة مثل حمض الخليك (CH₃COOH) أو حمض اللبنيك بشكل سريع أو واضح كما يتفاعل مع الأحماض المؤكسدة.ومع ذلك، في بعض التفاعلات مع الأحماض القوية أو المؤكسدة، يتفاعل النحاس بطرق مختلفة، إليك بعض الأمثلة على تفاعلات النحاس مع الأحماض:
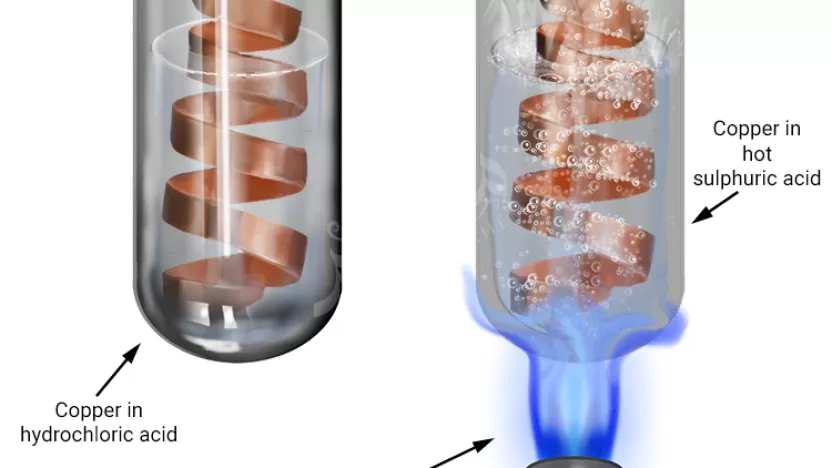
- حمض الكبريتيك المركز (H₂SO₄): يتفاعل النحاس مع الحمض ليُنتج كبريتات النحاس (CuSO₄)، ثاني أكسيد الكبريت (SO₂)، و ماء.
- حمض الكبريتيك المخفف: يتفاعل النحاس مع الحمض ليُنتج كبريتات النحاس و غاز الهيدروجين (H₂).
- حمض الهيدروكلوريك (HCl): لا يتفاعل النحاس مع الحمض، ولكن يتفاعل مع أوكسيد النحاس لتكوين كلوريد النحاس و ماء.
- حمض النيتريك (HNO₃): يتفاعل النحاس مع الحمض ليُنتج كبريتات النحاس (Cu(NO₃)₂)، و غاز ثاني أكسيد النيتروجين (NO₂).
- حمض الأسيتيك (CH₃COOH): يتفاعل النحاس مع الحمض ببطء ليُنتج أسيتات النحاس و غاز الهيدروجين.
ما هو الدافع الذي يجعل النحاس يتفاعل مع حمض الكبريتيك؟
- الدافع الذي يجعل النحاس يتفاعل مع حمض الكبريتيك المركز هو أن حمض الكبريتيك المركز الساخن يعمل كمؤكسد قوي، وليس مجرد مانح لأيونات الهيدروجين (H⁺) كما في الأحماض المخففة.
- في العادة، النحاس لا يتفاعل مع الأحماض المخففة مثل HCl أو H₂SO₄ المخفف، لأنه يقع أسفل الهيدروجين في السلسلة الكهروكيميائية، أي أنه لا يستطيع إزاحة الهيدروجين من الحمض. ولكن مع حمض الكبريتيك المركز والساخن، تحدث عملية أكسدة للنحاس:
- النحاس (Cu) يُفقد إلكترونات ويتحوّل إلى أيون النحاس الثنائي (Cu²⁺).
- في المقابل، يتم اختزال حمض الكبريتيك بإنتاج غاز ثاني أكسيد الكبريت (SO₂).
ما هو حامض الكبريتيك؟
حمض الكبريتيك (H₂SO₄) هو أحد أقوى الأحماض المعدنية وأكثرها استخدامًا في الصناعات. يُعرف أيضًا باسم زيت الزاج أو الزاج الأبيض.
خصائص حمض الكبريتيك
- الاسم الكيميائي: حمض الكبريتيك (Sulfuric Acid)
- الصيغة الجزيئية: H₂SO₄
- الحالة: سائل زيتي عديم اللون (أحيانًا مائل للصفرة)
- قوي جداً وحارق
- يمتص الرطوبة من الجو (ممتص للرطوبة - Hygroscopic).
استخدامات حامض الكبريتيك
- صناعة البطاريات (خاصة بطاريات السيارات)
- تنقية المعادن مثل النحاس والحديد
- صناعة الأسمدة (مثل السوبر فوسفات)
- تصنيع المواد الكيميائية الأخرى
- معالجة المياه
- صناعة المتفجرات والأصباغ والمنسوجات.
لماذا يستخدم حمض الكبريتيك في تعدين النحاس؟
يُستخدم حمض الكبريتيك (H₂SO₄) في تعدين النحاس تحديدًا في مرحلة الاستخلاص الكيميائي (leaching) وليس في الصهر، وذلك لعدة أسباب:
السبب الرئيسي لاستخدامه:
- لأنه يذيب أكاسيد النحاس الموجودة في الخامات قليلة التركيز (مثل خام الأكسيد)، فينتج عن ذلك محلول كبريتات النحاس (CuSO₄)، الذي يمكن بعده استخلاص النحاس النقي باستخدام التحليل الكهربائي.
العملية باختصار:
- ترشيح الخامة بحمض الكبريتيك: يُرش الخام أو يُنقع في حمض الكبريتيك.
- يتفاعل الحمض مع أكسيد النحاس (CuO): CuO + H2SO4 = CuSO4 + H2O
- يُجمع محلول كبريتات النحاس (CuSO₄).
- يُستخلص النحاس النقي من المحلول عبر الترسيب أو التحليل الكهربائي.
لماذا يُستخدم هذا الأسلوب؟
- لأنه أقل تكلفة من الصهر التقليدي.
- يُناسب الخامات منخفضة التركيز التي لا يُجدي فيها الصهر اقتصادياً.
- يمكن تطبيقه في الموقع مباشرة (heap leaching).
- هذه الطريقة تُستخدم غالبًا مع الخامات الأكسيدية (مثل مالاكيت وأزورايت)، وليس مع الخامات الكبريتيدية التي تحتاج معالجة حرارية.
دور حمض الكبريتيك في التفاعل
دور حمض الكبريتيك يختلف باختلاف نوع التفاعل، وقد يكون:
- مانحًا لأيون H: في التفاعلات الحمضية القاعدية (Neutralization)، يمنح H⁺. مثال: H2SO4 + 2NaOH → Na2SO4 + 2H2O
- عاملًا مؤكسدًا: في التفاعلات مع بعض الفلزات أو المواد العضوية، يؤكسد المادة الأخرى. مثال: مع النحاس المركز: Cu+2H2SO4(مركز)→2H2OCu + 2H_2SO_4
- مُحفزًا للتفاعل: في بعض التفاعلات العضوية مثل نزع الماء (Dehydration)، يعمل كمحفّز.
- وسطًا أو مذيبًا للتفاعل: يُستخدم كوسط تفاعل لإذابة المواد الصلبة وتحفيز التفاعلات بين الأيونات.
ما الذي لا يتفاعل مع حمض الكبريتيك؟
- حمض الكبريتيك (H₂SO₄) حمض قوي جدًا ويتفاعل مع معظم المواد، لكن هناك بعض المواد لا تتفاعل معه أو مقاومة لتأثيره، ومنها:
- الذهب (Au) والبلاتين (Pt): لا يتفاعلان مع حمض الكبريتيك حتى عند تركيزه أو تسخينه، والسبب: هذه الفلزات نبيلة جدًا ومقاومة للأكسدة.
- الفلوروبلاستيك (مثل تفلون - Teflon): مقاوم جدًا لحمض الكبريتيك ولا يتفاعل معه، ويُستخدم غالبًا في تغليف أواني التفاعل.
- الزجاج المقسى (نوع معين): لا يتفاعل مع حمض الكبريتيك، لذا يُستخدم في أنابيب وأدوات المعامل.
- البولي إيثيلين والبولي بروبيلين (مواد بلاستيكية خاصة): لا تتفاعل مع الحمض وتُستخدم في تصنيع حاويات نقله.
- الرصاص (Pb): يتفاعل ببطء شديد مع حمض الكبريتيك المركز ويُكون طبقة من كبريتات الرصاص (PbSO₄) التي تحمي المعدن من المزيد من التفاعل.
فوائد وأضرار حمض الكبريتيك
إليك فوائد وأضرار حمض الكبريتيك (H₂SO₄) بشكل مبسّط ومباشر:
فوائد حمض الكبريتيك:
- الصناعة الكيميائية: يُستخدم في تصنيع الأسمدة (مثل السوبر فوسفات)، ويدخل في إنتاج الأحماض الأخرى مثل حمض الهيدروكلوريك وحمض الفوسفوريك.
- صناعة البطاريات: يُستخدم كمحلول إلكتروليتي في بطاريات السيارات (بطاريات الرصاص الحمضية).
- تنقية المعادن: يستخدم في ترشيح الخامات (مثل النحاس) لإذابة الأكاسيد واستخلاص الفلزات.
- معالجة المياه: يُساعد في تعديل درجة الحموضة في بعض محطات معالجة المياه.
- صناعة الأدوية والأصباغ والمنسوجات: يدخل في عدد من التفاعلات الكيميائية لتحضير مركبات عضوية وغير عضوية.
أضرار حمض الكبريتيك:
- مادة شديدة التآكل: يسبب حروقًا جلدية خطيرة عند ملامسته للجلد، وقد يُسبب تلفًا دائمًا في العين في حال التلامس.
- أبخرته خطرة: استنشاق بخار حمض الكبريتيك يسبب تهيجًا شديدًا في الجهاز التنفسي.
- تآكل المواد: يمكنه تدمير المعادن والأنسجة والمواد العضوية.
- خطر بيئي: تسربه إلى التربة أو المياه يمكن أن يلوث البيئة ويؤذي الكائنات الحية.
احتياطات السلامة عند استخدام حامض الكبريتيك
- ارتداء نظارات واقية وقفازات.
- العمل في مكان جيد التهوية.
- عدم خلطه مع الماء مباشرة (يُضاف الحمض إلى الماء ببطء وليس العكس!).
للإستفادة من هذا المقال انسخ الرابط
https://mafahem.com/sl_21272